学院Bio-road生物医用材料研发团队在国际知名期刊《Bioactive Materials》上发表最新研究成果
发布时间: 2021-04-17 14:14:37 已阅读:近日,我院Bio-road生物医用材料研发团队在材料领域国际知名期刊《Bioactive Materials》(影响因子:8.724)上发表题为“Erythrocytemembrane-camouflaged nanoworms with on-demand antibiotic release foreradicating biofilms using near-infrared irradiation”(一种近红外控制的纳米“蠕虫”用于按需释放抗生素和治疗生物膜感染)的研究论文(DOI: 10.1016/j.bioactmat.2021.01.032)。该研究成果报道了一种纳米“蠕虫”可在近红外控制下按需释放抗生素并用于治疗生物膜类的感染。
细菌感染是临床常见的威胁人类健康甚至生命的疾病。在过去的几十年里,抗生素的出现使细菌感染的有效治疗成为可能。然而,由于抗生素的滥用,耐药细菌一直在增加。此外,生物膜的形成阻碍了抗生素的渗透,使抗生素失活,从而进一步增加了细菌的耐药性。因此,细菌感染变得更加危险,预计全世界将有1000万人死于细菌感染。解决这一问题的关键在于两点:①局部使用抗生素,使抗生素只在感染部位释放,减少抗生素滥用;②消除生物膜,使释放到感染部位的抗生素可以有效渗透治疗细菌感染。
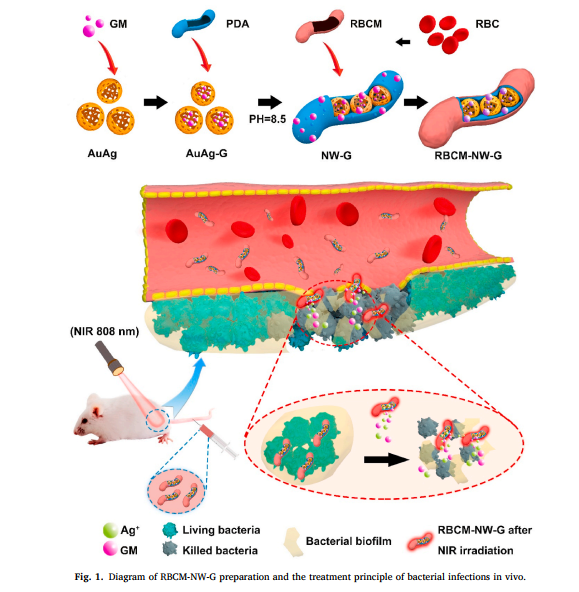
纳米“蠕虫”制备示意图及治疗体内细菌感染的原理图
基于此,本课题组制备了一种具有纳米“蠕虫”结构的抗菌剂,提出了一种联合抗菌策略,为合理使用抗生素提供了新的方法。“蠕虫”内部为具有中空多孔结构和光热效应的金银纳米笼,外部为生物相容性良好的聚多巴胺。并且将抗生素负载到金银纳米笼内部,在聚多巴胺的外部包裹红细胞膜进行伪装以增加在血液中的循环时间。
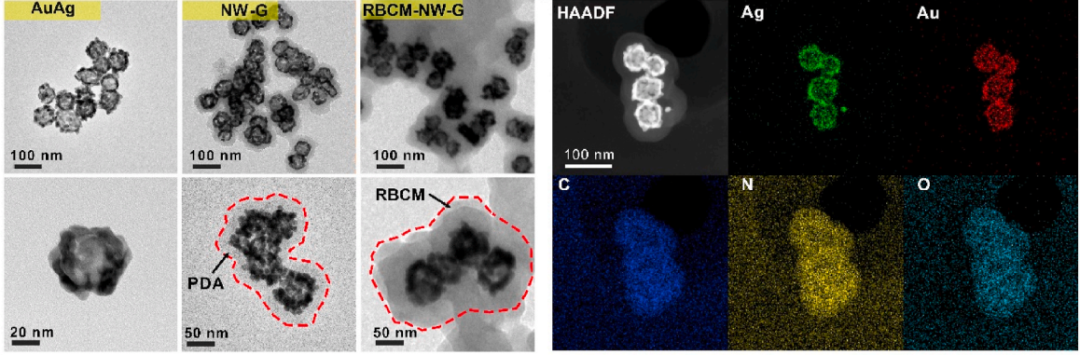
纳米“蠕虫”的微观结构
使用时,将这种纳米“蠕虫”注射到体内,并在感染部位进行近红外照射。由于红细胞膜的伪装使纳米“蠕虫”可以在感染部位有效聚集,然后在近红外激发下,金纳米笼温度升高并释放出银离子进行杀菌。温度升高还可破坏生物膜。
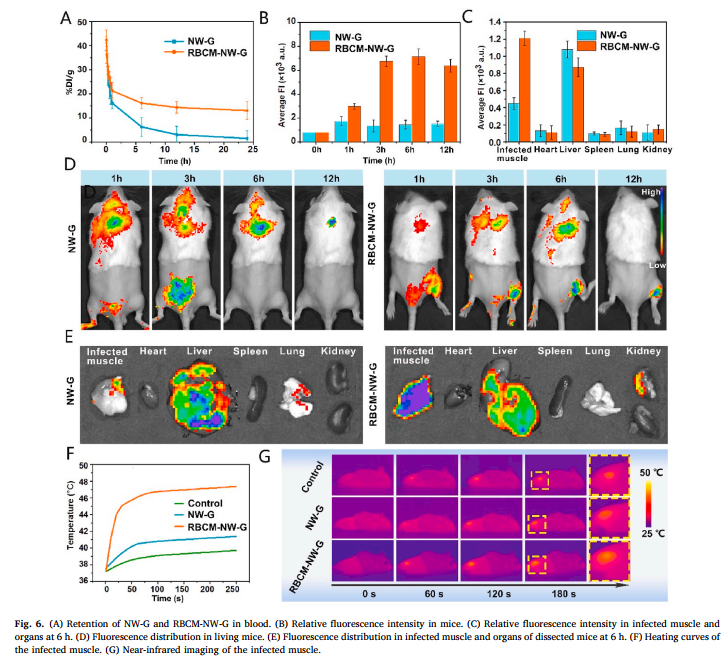
纳米“蠕虫”治疗活体细菌感染小鼠体内实验结果
此外,温度升高能够促使负载在金银纳米笼内部的抗生素释放。最终实现通过近红外控制进行银离子释放、光热效应、抗生素三者联合的协同抗菌。该研究成果降低了细菌感染死亡的风险,减少了抗生素滥用导致的细菌耐药,为抗生素的合理使用和治疗生物膜相关的细菌感染提供了新的思路。
本团队的2020级硕士生冉泺萧为本文第一作者,2019级博士生卢必涛为共同第一作者,蓝广芊副教授为本文的通讯作者。该项研究得到了国家自然科学基金的资助。西南大学Bio-Road生物医用材料研发团队由蓝广芊副教授带领的长期致力于伤口止血用与创伤愈合用生物材料的研究团队。团队依托西南大学家蚕基因组国家重点实验室、西南大学蚕桑纺织与生物质科学学院以及重庆市生物质纤维材料与现代纺织工程技术研究中心,拥有成熟的实验平台与雄厚的研发实力,近3年在Advanced Functional Materials、ACS Sustainable Chemistry & Engineering、Carbohydrate Polymers等杂志上发表高水平SCI论文40余篇,获国家发明专利授权10余项。
本研究成果原文链接:https://www.sciencedirect.com/science/article/pii/S2452199X2100044X
审稿人:蓝广芊
撰稿人:余堃、冉泺萧