学院Bio-road生物医用材料研发团队再次在《ACS Applied Materials & Interfaces》期刊上发表最新研究成果
发布时间: 2021-06-02 18:25:01 已阅读:近日,我院Bio-road生物医用材料研发团队在材料领域知名期刊《ACS Applied Materials & Interfaces》(影响因子:8.758) 上发表题为“Magnetically Guided Nanoworms for PreciseDelivery to Enhance In Situ Production of Nitric Oxide to Combat FocalBacterial Infection In Vivo” (磁介导纳米蠕虫精准递送一氧化氮治疗体内细菌感染) 的研究论文。该成果报道了一种具有核壳结构的蠕虫状递送系统,实现磁响应、近红外响应的光热动力学、化学动力学及NO气体高效协同抗菌,为体内细菌生物膜的治疗提供了一种新型的非抗生素基靶向治疗策略。

细菌通过呼吸道、伤口等各种途径进入人体,在特定的部位肆意繁殖形成由细菌外基质包覆的(ECM)细菌群落—生物膜。科学研究证明,生物膜对抗生素的承受能力是普通单个细菌菌落的1000倍,被认为是导致人体死亡的最大威胁之一。目前,针对体内生物膜的感染,抗生素依然是目前主要的方式。其通过注射进入人体,由于缺乏主动靶向感染区域的能力,仅少部分能发挥抗菌作用。为提升治疗效果,一般通过提抗生素浓度来增强感染部位抗生素的富集,但是过度使用的抗生素则会加速耐药性细菌产生,反而为细菌感染的治疗加大了难度。因此,开发出一种非抗生素基靶向抗菌策略已经迫在眉睫。
为解决上述问题,本研究设计了一种具有核壳结构的蠕虫状纳米递送系统(长径/短径:186.2 ± 54.4 nm/119.3 ± 21.1 nm)。其核心为负载了纳米氧化铁的金/银笼(Fe2O3-AuAg NPs),其壳层为精氨酸修饰的聚多巴胺(A-PDA)涂层。在应用过程中,该纳米蠕虫通过外部磁场靶向生物膜感染部位,由近红外激光照射产生局部高热,触发活性活性氧与精氨酸之间的级联催化反应,原位释放NO气体,实现光热动力学、化学动力学及NO气体高效协同抗菌。
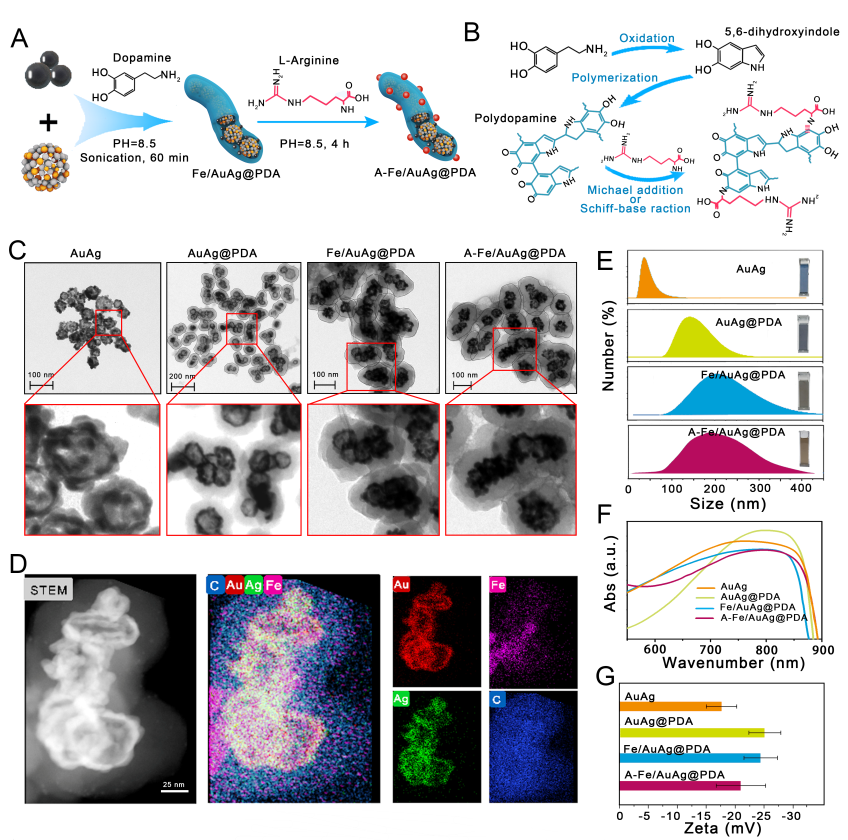
图1 纳米蠕虫的制备过程及微观结构
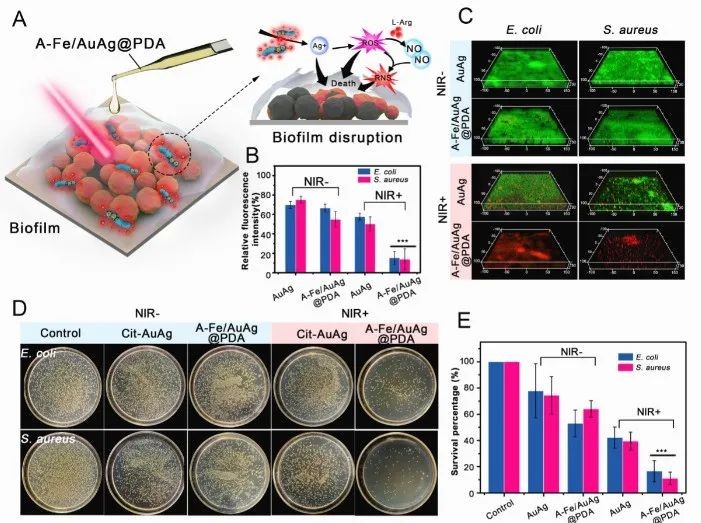
图2 体外生物膜消除
另外,这项工作通过荧光成像技术、近红外成像技术、体内组织免疫组化测试、动物体生物膜感染模型等证明了该纳米蠕虫在外部磁场指导下,可以实现在感染部位的高效富集,进而发挥联合抗菌作用,可在15天内消除小鼠大腿生物膜感染。同时,该纳米蠕虫通过肝脏和脾脏代谢出体外,对动物体组织无毒副作用。综上所述,本工作阐明纳米蠕虫的构成及作用发挥机制,从多个维度证明了其对生物膜的消除作用,为非抗生素基抗菌材料的设计提供了参考。
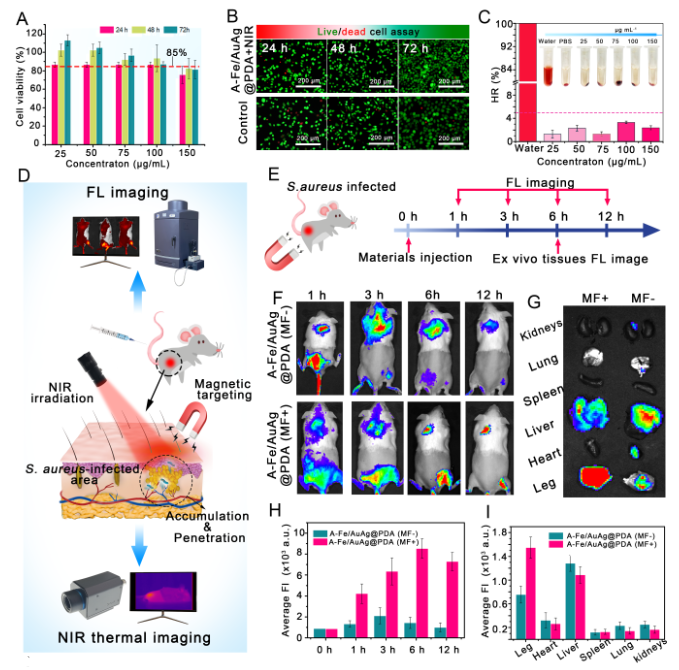
图3 体内生物膜靶向治疗
西南大学桑蚕纺织与生物质科学学院2019级博士研究生卢必涛为本文第一作者,及桑蚕纺织与生物质科学学院胡恩岭副教授为共同第一作者,代方银教授和蓝广芊副教授为本文的共同的通讯作者。该研究得到了中国农业研究系统专项资金、国家自然科学基金和中央高校基本科研基金的资助。
Bio-road研发团队长期致力于伤口止血用与创伤愈合用生物材料的研究,近三年课题组成员共主持包括国防项目,国家自然科学基金,重庆市科技攻关项目,重庆市自然科学基金在内的10余项科研项目。在AdvancedFunctional Materials、ACS Sustainable Chemistry & Engineering、CarbohydratePolymers等杂志上发表高水平SCI论文40余篇;已申请国家发明专利12项,其中授权4项。
本研究成果原文链接:https://pubs.acs.org/doi/full/10.1021/acsami.1c04330
审稿人:蓝广芊
撰稿人:余堃、卢必涛