肖波教授课题组在基于丝素蛋白纳米药物研究领域取得重要进展
发布时间: 2020-09-27 12:50:58 已阅读:近日,我院肖波教授课题组在“药剂学”领域排名第一的期刊Journal of Controlled Release(IF = 7.727)连续发表2篇关于丝素蛋白纳米药物的原创论文。
1. 基于丝素蛋白的五重刺激响应型纳米粒子用于肿瘤诊疗一体化
8月9日,Journal of Controlled Release在线发表了题为“Multi-responsive nanococktails with programmable targeting capacity for imaging-guided mitochondrial phototherapy combined with chemotherapy”的研究性论文。肖波教授和四川大学华西医院柯博文教授为该论文共同通讯作者,家蚕基因组生物学国家重点实验室为第一单位。
癌症已成为严重威胁人民生命安全的世界性公共卫生问题。光疗,包括光热疗法(PTT)和光动力疗法(PDT),依靠化学光敏剂(PSs)吸收近红外光(NIR)的能量,产生大量的热量或单线态氧(1O2),对生物分子造成不可逆的损伤,从而导致肿瘤细胞凋亡。然而,由于热能分布不均和肿瘤乏氧环境的影响,它不能完全消融癌细胞,存活下来的癌细胞可诱发局部复发或远端转移。通过光疗和化疗的联合,可以将残留的肿瘤细胞摧毁,从而阻止肿瘤的复发和转移(图1)。
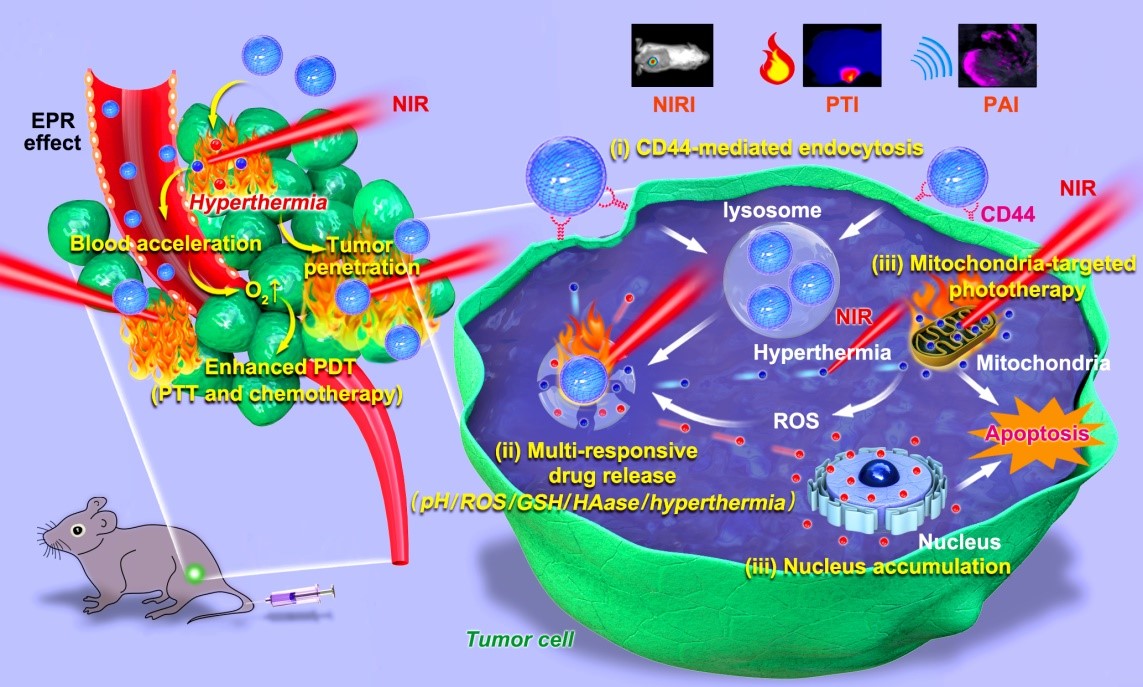
图1. HA修饰共载NIR770/DOX纳米粒子用于肿瘤靶向协同诊疗一体化
在此,该合作团队开发了一种结合癌症成像示踪与靶向治疗的诊疗一体化纳米鸡尾酒诊疗法,将具有线粒体靶向功能的ICG类似物(NIR770)和抗癌药物阿霉素(DOX)共载于丝素蛋白纳米粒子,并利用透明质酸(HA)对其表面进行功能化。实验表明,所获得的纳米粒子HNDNPs具有明显的酸性pH、H2O2、GSH、高温和透明质酸酶(HAase)五重刺激响应性。抗肿瘤实验结果表明,在NIR照射下实现了高效的多模态成像指导下的PTT- PDT和化疗协同治疗,具有比单一疗法更好的治疗效果。这种兼具肿瘤细胞靶向、线粒体靶向、五重刺激响应性、多模态成像、光疗和化疗等功能于一体的纳米鸡尾酒诊疗法,可以为下一代癌症靶向协同诊疗方案提供了新的设计思路。
2. 基于丝素蛋白的肿瘤靶向纳米药物用于恶性肿瘤治疗
8月31日,Journal of Controlled Release在线发表了题为“Inhibition of growth and lung metastasis of breast cancer by tumor-homing triple-bioresponsive nanotherapeutics”的研究性论文。肖波教授、代方银教授和四川大学华西医院柯博文教授为该论文共同通讯作者,家蚕基因组生物学国家重点实验室为第一单位。LyP-1多肽(CGNKRTRGC)是一种对肿瘤细胞、肿瘤淋巴管内皮细胞、肿瘤细胞内线粒体有特异性亲和作用的环状九肽。槲皮素(QU)是一种天然的黄酮类化合物,广泛存在于多种植物的花、叶和果实中,具有抑制肿瘤生长、调控肿瘤相关信号转导通路和逆转多药耐受等功能。然而,QU的水溶性差、代谢迅速和生物利用度低的问题限制了其临床转化。基于此,该团队设计了一种兼具肿瘤细胞和线粒体靶向的LyP-1修饰载槲皮素纳米药物。体外研究发现该纳米药物(LyP-1-QU-NPs)能通过破坏线粒体功能、抑制肿瘤细胞迁移、抗糖酵解和促进肿瘤细胞自噬等途径抑制乳腺癌的生长和转移(图2)。后续研究还发现LyP-1-QU-NPs不仅具有优异的生物安全性,并且能缓解肿瘤生长和恶性转移,从而显著提高小鼠生存期。
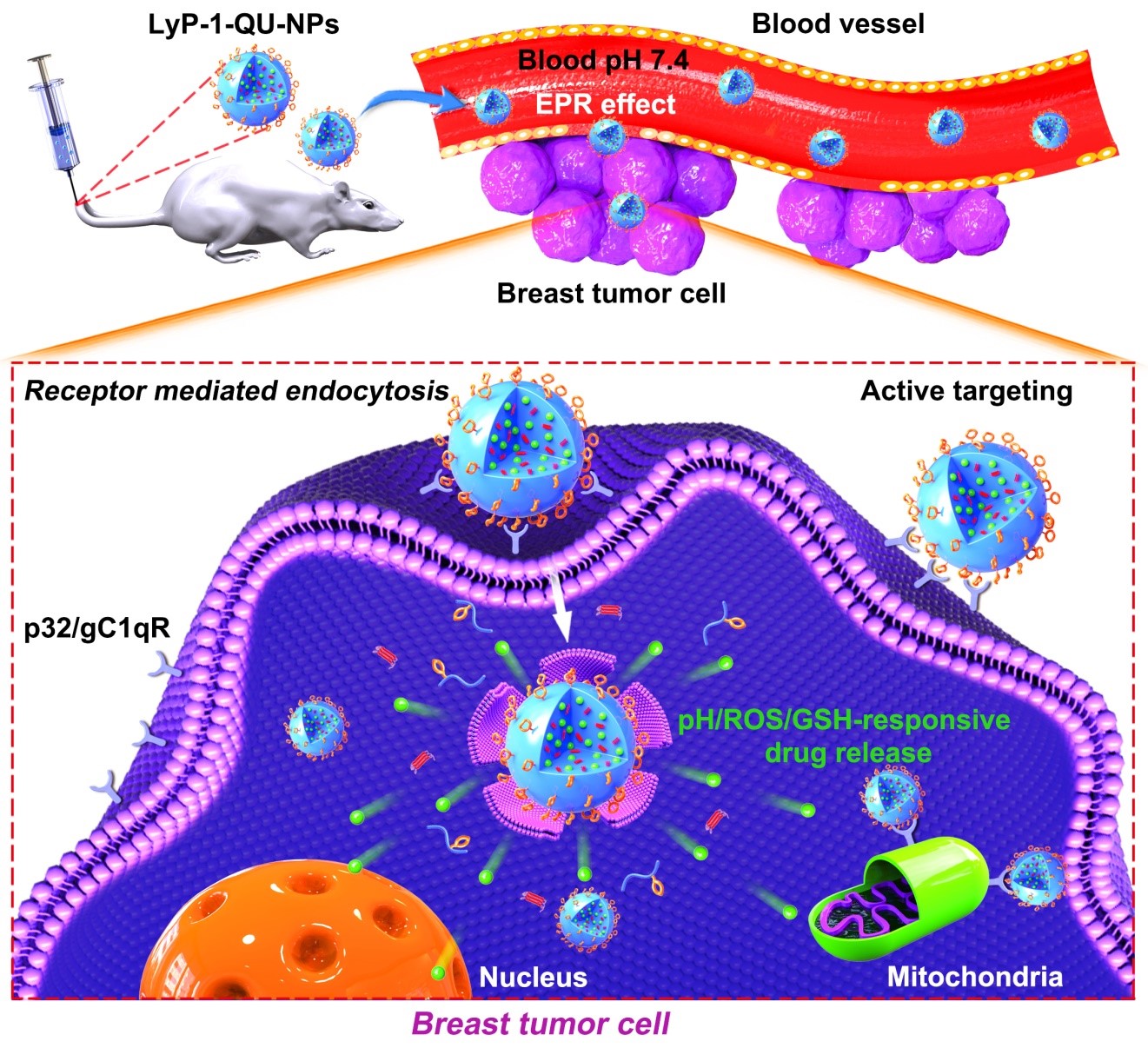
图2. LyP-1-QU-NPs抑制乳腺癌生长及其转移
该研究得到了国家自然科学基金、国家“双一流”学科建设经费、中央高校基本业务费优青团队培育项目、国家863计划和国家现代农业产业技术体系专项等项目的资助。
据悉,肖波课题组长期围绕慢性炎症性疾病和恶性肿瘤治疗展开研究,相继在Gastroenterology、ACS nano、Biomaterials、Journal of Controlled Release、Molecular Therapy和Theranostics等国际权威学术期刊上发表学术论文40余篇。